(二)真核生物蛋白质的分泌
真核生物不但有细胞核、细胞质和细胞膜,而且还有许多膜性结构的细胞器,在细胞须内合成的蛋白质怎样的到达细胞的不同部位呢?了解比较清楚的是分泌性蛋白质的转运。
像原核细胞一要,真核细胞合成的蛋白质N端也有信号肽也能形成两个α螺旋的发夹结构,这个结构可插入到内质网的膜中,将正在合成中的多肽链带和内质网内腔。80年代中期在胞浆中发现一种由小分子RNA和蛋白质共同组成的复合物,它能特异地与信号肽识别而命名为信号肽识别颗粒。它的作用是识别信号肽与核糖体结合并暂时阻断多肽链的合成。内质网外膜上的SRP受体,当ARP与受体结合后,信号肽就可插入内质网进入内腔,被内质网内膜壁上的信号肽酶水解除去SRP与受体结合后,信号肽就可插入内质网进入内腔,被内质网内腔壁上的信号肽酶水解除去SRP与受体解离并进入新的循环,而信号肽后序肽段也进入内质网内腔,并开始继续合成多肽链(图18-19)。
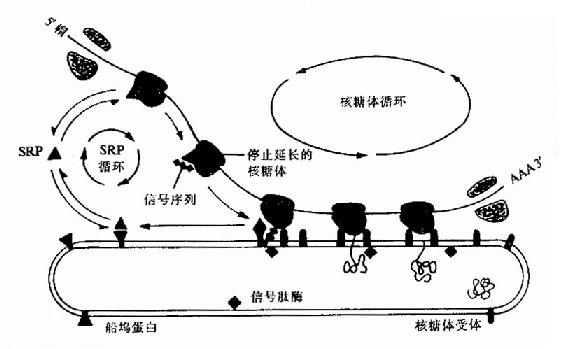
图18-19 在蛋白质越过内质网的转运过程中,SRP和船坞蛋白(或SRP受体)的作用
SRP对翻译阶段作用的重要生理意义在于:分泌性蛋白及早进入细胞的膜性细胞,能够正确的折叠、进行必要的后期加工与修饰并顺利分泌出细胞。
现以哺乳动物的胰岛素为例说明这种分泌过程。胰岛素由51个氨基酸残基组成,但胰岛素mRNA的翻译产和在兔网织红细胞无细胞翻译体系中为86个氨基酸残基,称为胰岛素原,在麦胚无细胞翻译系统中为110个氨基酸残基组成的前胰岛素原,后来证明,在前胰岛素原的N末端有一段富含疏水氨基酸的肽段做为信号肽,使前胰岛素原能穿越内质网膜进入内质网内腔,在内腔壁上信号肽被水介。所以在哺乳动物细胞内,当多肽链合成完成时,前胰岛素原已成为胰岛素原。然后胰岛素原被运到高尔基复合体,切去C肽成为成熟的胰岛素,最终排出胞外。像真核细胞的前清蛋白,免疫球白轻链,催乳素等都有相似的分必方式。
