(一)蛋白质的二级结构
蛋白质的二级结构(secondarystructure)是指多肽链中主链原子的局部空间排布即构象,不涉及侧链部分的构象。
1.肽键平面(或称酰胺平面,amide plane)。
Pauling等人对一些简单的肽及氨基酸的酰胺等进行了X线衍射分析,得出图1-2所示结构,从一个肽键的周围来看,得知:
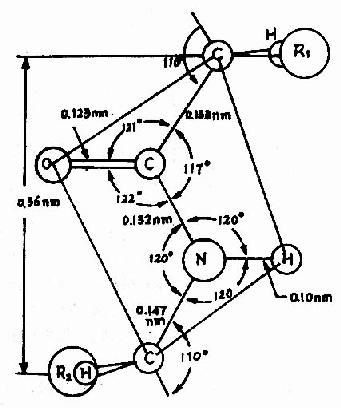
图1-2 肽键平面示意图
(1) ![[/alt][/img]中的C-N键长0.132nm,比相邻的N-C单键(0.147nm)短,而较一般C=N双键(0.128nm)长,可见,肽键中-C-N-键的性质介于单、双键之间,具有部分双键的性质,因而不能旋转,这就将固定在一个平面之内。</p><p>(2) [img]https://baike.zhuayao.net/Uploads/zyzy/lilunshuji/shengwuhuaxueyufenzishengwuxue/shengwuhuaxueyufenzishengwuxue010.jpg[alt]](https://baike.zhuayao.net/Uploads/zyzy/lilunshuji/shengwuhuaxueyufenzishengwuxue/shengwuhuaxueyufenzishengwuxue009.jpg) 肽键的C及N周围三个键角之和均为360°,说明都处于一个平面上,也就是说
肽键的C及N周围三个键角之和均为360°,说明都处于一个平面上,也就是说 ![[/alt][/img]六个原子基本上同处于一个平面,这就是肽键平面。肽链中能够旋转的只有α碳原子所形成的单键,此单键的旋转决定两个肽键平面的位置关系,于是肽键平面成为肽链盘曲折叠的基本单位。</p><p>(3) 肽键中的C-N既具有双键性质,就会有顺反不同的立体异构,已证实 [img]https://baike.zhuayao.net/Uploads/zyzy/lilunshuji/shengwuhuaxueyufenzishengwuxue/shengwuhuaxueyufenzishengwuxue012.jpg[alt]](https://baike.zhuayao.net/Uploads/zyzy/lilunshuji/shengwuhuaxueyufenzishengwuxue/shengwuhuaxueyufenzishengwuxue011.jpg) 处于反位(见图1-3)。
处于反位(见图1-3)。
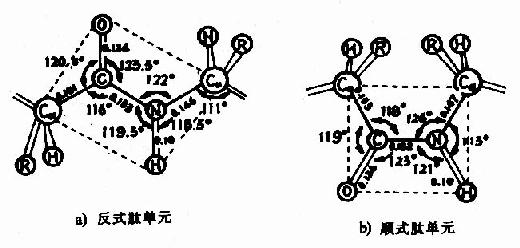
图1-3 反式肽单元和顺式肽单元
2.蛋白质主链构象的结构单元
1)α-螺旋Pauling等人对α-角蛋白(α-keratin)进行了X线衍射分析,从衍射图中看到有0.5~0.55nm的重复单位,故推测蛋白质分子中有重复性结构,并认为这种重复性结构为α-螺旋(α-helix)见图1-4。
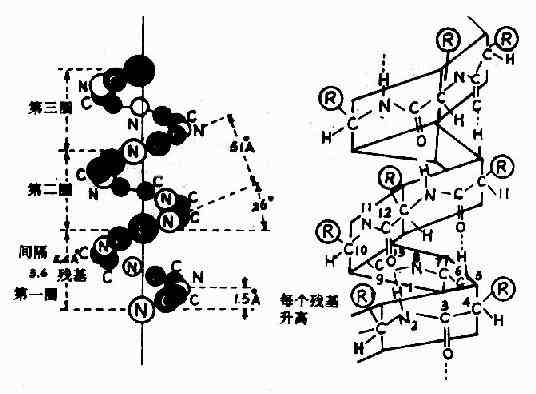
图1-4 蛋白质分子的α-螺旋
α-螺旋的结构特点如下:
(1)多个肽键平面通过α-碳原子旋转,相互之间紧密盘曲成稳固的右手螺旋。
(2)主链呈螺旋上升,每3.6个氨基酸残基上升一圈,相当于0.54nm,这与X线衍射图符合。
(3)相邻两圈螺旋之间借肽键中C=O和H桸形成许多链内氢健,即每一个氨基酸残基中的NH和前面相隔三个残基的C=O之间形成氢键,这是稳定α-螺旋的主要键。
(4)肽链中氨基酸侧链R,分布在螺旋外侧,其形状、大小及电荷影响α-螺旋的形成。酸性或碱性氨基酸集中的区域,由于同电荷相斥,不利于α-螺旋形成;较大的R(如苯丙氨酸、色氨酸、异亮氨酸)集中的区域,也妨碍α-螺旋形成;脯氨酸因其α-碳原子位于五元环上,不易扭转,加之它是亚氨基酸,不易形成氢键,故不易形成上述α-螺旋;甘氨酸的R基为H,空间占位很小,也会影响该处螺旋的稳定。
2)β-片层结构Astbury等人曾对β-角蛋白进行X线衍射分析,发现具有0.7nm的重复单位。如将毛发α-角蛋白在湿热条件下拉伸,可拉长到原长二倍,这种α-螺旋的X线衍射图可改变为与β-角蛋白类似的衍射图。说明β-角蛋白中的结构和α-螺旋拉长伸展后结构相同。两段以上的这种折叠成锯齿状的肽链,通过氢键相连而平行成片层状的结构称为β-片层(β-pleatedsheet)结构或称β-折迭(图1-5)。
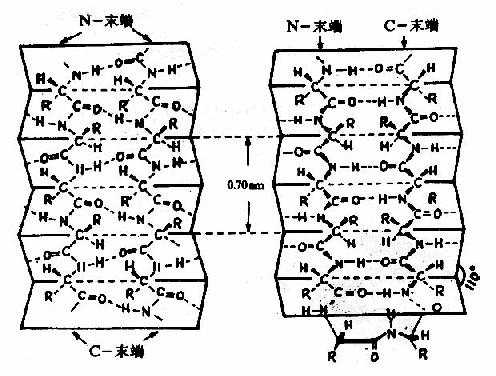
图1-5 蛋白质分子中的β-片层结构
左:顺向平行 右:逆向平行
β-片层结构特点是:
①是肽链相当伸展的结构,肽链平面之间折叠成锯齿状,相邻肽键平面间呈110°角。氨基酸残基的R侧链伸出在锯齿的上方或下方。
②依靠两条肽链或一条肽链内的两段肽链间的C=O与H梄形成氢键,使构象稳定。
③两段肽链可以是平行的,也可以是反平行的。即前者两条链从“N端”到“C端”是同方向的,后者是反方向的。β-片层结构的形式十分多样,正、反平行能相互交替。
④平行的β-片层结构中,两个残基的间距为0.65nm;反平行的β-片层结构,则间距为0.7nm。
3)β-转角
蛋白质分子中,肽链经常会出现180°的回折,在这种回折角处的构象就是β-转角(β-turn或β-bend)。β-转角中,第一个氨基酸残基的C=O与第四个残基的N桯形成氢键,从而使结构稳定(图1-6)。
![[/alt][/img]</p><p>图1-6 蛋白质分子中的β-转角</p><p>4)无规卷曲</p><p>没有确定规律性的部分肽链构象,肽链中肽键平面不规则排列,属于松散的无规卷曲(random coil)。</p><p>[img]https://baike.zhuayao.net/Uploads/zyzy/lilunshuji/shengwuhuaxueyufenzishengwuxue/shengwuhuaxueyufenzishengwuxue017.jpg[alt]](https://baike.zhuayao.net/Uploads/zyzy/lilunshuji/shengwuhuaxueyufenzishengwuxue/shengwuhuaxueyufenzishengwuxue016.jpg)
图1-7 蛋白质的超二级结构示意
a.αα组合 b.βββ组合 c.βαβ组合
